CXCL12(C-X-C motif chemokine ligand 12)もしくはSDF-1(stromal cell-derived factor 1)は、ヒトでは10番染色体に位置するCXCL12遺伝子にコードされるケモカインである。CXCL12は多くの組織や細胞種において普遍的に発現している。SDF-1にはSDF-1α、βと呼ばれる種類が存在し、ケモカインファミリーに属する。ケモカインは白血球を活性化し、多くの場合リポ多糖、TNF、IL-1などの炎症性刺激によって誘導される。ケモカインは2つのジスルフィド結合を形成する4つの保存されたシステイン残基によって特徴づけられ、CXCL12はシステイン残基のペアが1アミノ酸によって隔てられているCXCサブファミリーに属する。CXCL12シグナルはいくつかのがんでも観察される。CXCL12遺伝子には27種類のSNPが含まれており、冠動脈疾患のリスクの増加と関係している。
構造
遺伝子
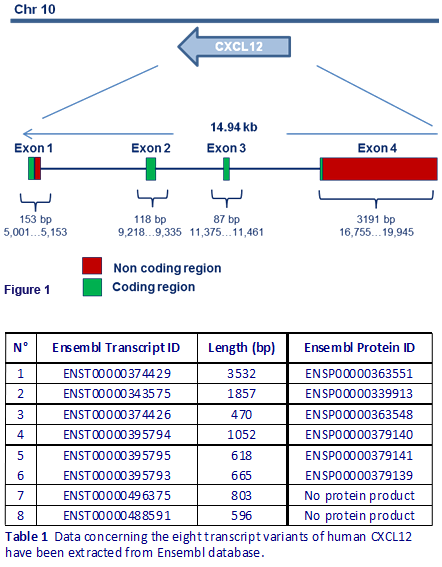
CXCL12遺伝子は10番染色体のバンド10q11.1に位置し、9つのエクソンから構成される。この遺伝子からは選択的スプライシングによって7種類のアイソフォームが産生される。
タンパク質
CXCL12/SDF-1はインタークリンα(CXCケモカイン)ファミリーに属する。同じ遺伝子からの選択的スプライシングによって、SDF-1α/CXCL12aとSDF-1β/CXCL12bの2つの形態で産生される。ケモカインは保存された4つのシステイン残基によって特徴づけられ、これらは2つのジスルフィド結合を形成している。CXCL12はCXCケモカインに属し、システインの最初のペアは1アミノ酸によって隔てられている。CXCL12のN末端の最初の8残基は受容体活性化のための結合部位として機能するが、受容体の活性化に直接関与しているのはLys1とPro2のみである。一方、ループ領域に位置するRFFESHモチーフ(12–17番残基)は受容体への結合のためのドッキング部位として機能する。
機能
マウスでは、CXCL12は脳、胸腺、心臓、肺、肝臓、腎臓、脾臓、血小板、骨髄など多くの組織で発現している。CXCL12はリンパ球に対して強い誘引効果を示す。胚発生の間、CXCL12は胎児肝臓から骨髄への造血系細胞の移動や大血管の形成を指示する。また、CXCL12シグナルはB細胞上のCD20の発現を調節することも示されている。CXCL12は間葉系幹細胞に対する誘引効果も示し、炎症性骨破壊部位で発現して破骨細胞発生に対する抑制効果を媒介している。
成体では、CXCL12はCXCR4依存的機構によって骨髄から血管内皮前駆細胞(EPC)をリクルートし、血管新生に重要な役割を果たす。
CXCR4はCXCL12の受容体であり、以前にはLESTRもしくはfusinとも呼ばれていた。CXCL12-CXCR4間相互作用は(他のケモカインやその受容体とは異なり)排他的であると考えられてきたが、近年ではCXCL12がCXCR7(ACKR3)にも結合する可能性が示唆されている。CXCL12はHIV-1の細胞進入の際の主要なコレセプターとなっているCXCR4を遮断することで、CXCR4-tropic HIV-1株に対する内因性の阻害因子として機能する。
中枢神経系
胚発生時には、CXCL12は神経細胞の移動を指示することで小脳の形成に関与している。中枢神経系においては、CXCL12は細胞増殖、神経発生(神経組織の発生と成長)のほか、神経炎症にも寄与している。神経前駆細胞(NPC)は、グリア細胞と神経細胞に分化する幹細胞である。CXCL12は脳内の病変部位へのこれらの細胞の遊走、特に長距離の遊走を促進する。損傷部位に到着したNPCは、幹細胞を基盤とした組織修復を開始する。CXCL12/CXCR4軸は軸索や神経突起に対するガイダンスキューとなり、神経突起の成長や神経発生を促進する。他のケモカインと同様、CXCL12は炎症に寄与する細胞遊走にも関与している。中枢神経系においては、CXCL12は血液脳関門を越えて白血球を誘引することで神経炎症に関与する。CXCL12の過剰産生や蓄積は有害であり、その結果生じた炎症は重大な影響を引き起こす可能性がある。
臨床的意義
ヒトでは、CXCL12はいくつかの器官と関係した広範囲の医学的状態と関係していることが示唆されている。さらに、CXCL12シグナルはCXCR7シグナルとともに、膵臓がんの進行への関与が示唆されている。尿路系においては、CXCL12プロモーターのメチル化とPD-L1の発現は前立腺全摘除術後の患者の前立腺癌の生化学的再発に対する強力な予後バイオマーカーとなり、CXCL12のメチル化が監視療法(アクティブサーベイランス)戦略に有用であるかどうかを確認するためのさらなる研究が進行している。メラノーマ関連線維芽細胞はアデノシンA2B受容体の刺激によって線維芽細胞増殖因子やCXCL12の発現が刺激され、腫瘍微小環境の形成に寄与する。
臨床マーカー
CXCL12遺伝子を含む27遺伝子座に基づく多遺伝子リスクスコア研究によって、冠動脈疾患イベントの発生や再発のリスクの高い人物や、スタチン療法によって臨床的有用性が得られる人物が特定されている。この研究は住民コホート研究(the Malmo Diet and Cancer study)、そして一次予防コホート(JUPITER、ASCOT)と二次予防コホート(CARE、PROVE IT-TIMI 22)のランダム化比較試験に基づいている。
多発性硬化症
多発性硬化症(MS)では、免疫系と神経系の相互作用の欠陥によって神経症状が引き起こされる。MSは体内の免疫系が中枢神経系を攻撃することで生じた脱髄によって特徴づけられる。MS患者の脳脊髄液ではCXCL12濃度の上昇が観察される。CXCL12は血液脳関門を通過して軸索損傷に寄与する神経炎症を引き起こし、MSの進行に寄与する。
アルツハイマー病
CXCL12はMS患者には有害である可能性がある一方で、近年の研究ではこのケモカインがアルツハイマー病の進行の低下に有用である可能性が示唆されている。アルツハイマー病は認知機能が低下する認知症の最も一般的な形態である。アルツハイマー病の主な特徴は、β-アミロイドからなるプラーク(アミロイド斑)の蓄積である。マウスでは、こうしたプラークが生じたマウスに対するCXCL12の神経保護効果が示されている。PAK(p21-activated kinase)は樹状突起スパインの維持と関係したタンパク質であり、シナプスが軸索から情報を受け取る際に必要不可欠である。アルツハイマー病患者ではPAKの誤局在が生じているが、CXCL12処理によってこの誤局在が抑制されることがマウスでは示されている。さらに、このCXCL12による前処理はアミロイド斑の存在によって引き起こされるアポトーシスや酸化損傷を低下させる。
薬剤標的として
ケモカインやケモカイン受容体は形態形成、血管新生、免疫応答など複数の過程を調節しているため、薬剤開発の標的となると考えられている。特発性肺線維症患者の肺ではCXCR4の高発現がみられることが臨床試料から示されている。さらに、CXCL12/CXCR4が肺線維症の発症と関係していることを示す実験的証拠も得られている。消化管領域では、慢性膵炎の治療においてCXCL12-CXCR4軸が抗線維化治療の標的として研究が行われている。乳がんのマウスモデルでは、CXCL12の受容体であるCXCR4をプレリキサホル(AMD-3100)によって遮断することで、コンブレスタチンの有効性が高まることが示されており、おそらくマクロファージが腫瘍へリクルートされるのを防ぐことで機能していると考えられている。また、AMD-3100はG-CSFとともに造血幹細胞の血流への動員に広く用いられており、骨髄移植に向けた採取を可能にしている。
出典
関連文献